La fluorescence et la phosphorescence

À la lumière du jour, certains objets qu’on appelle « fluos », par exemple les encres de nos surligneurs, donnent l’impression d’être plus lumineux que les autres, comme s’ils étaient capables de renvoyer plus de lumière qu’ils n’en reçoivent. Ces effets sont encore plus marqués sous une lumière ultraviolette : les objets fluos apparaissent lumineux alors qu’ils ne reçoivent aucune lumière visible. D’autres objets appelés phosphorescents sont lumineux « dans le noir ». Comment est-ce possible ? Après avoir décrit une série d’observations sur la fluorescence et la phosphorescence dans notre page d’expériences, nous vous proposons ici de réfléchir à l’origine de ces phénomènes.
Qu'est ce que la fluorescence ?
Les objets classiques (non fluorescents) sont colorés parce qu’ils absorbent une partie de la lumière qu’ils reçoivent et renvoient le reste. Ainsi un objet jaune absorbe la partie bleue du spectre lumineux et renvoie le reste. L’énergie de la lumière absorbée est en général convertie en chaleur : elle met en vibration les atomes qui constituent le matériau absorbant. On s’en rend compte en se mettant au soleil : si on porte un vêtement noir, qui absorbe quasiment tout le spectre visible, on aura plus vite chaud qu’avec un vêtement blanc, qui renvoie quasiment toute la lumière.

Dans certains matériaux, il arrive qu’une partie de l’énergie lumineuse absorbée soit convertie en lumière, que l’objet émet à son tour. Ainsi lorsque l’objet est éclairé, non seulement il renvoie la lumière qu’il n’a pas absorbée mais en plus il émet de la lumière qu’il a « fabriquée » à partir de l’énergie lumineuse absorbée. Cette émission de lumière doit toutefois respecter la règle de conservation de l’énergie : un photon émis ne peut transporter plus d’énergie que le photon absorbé (les photons sont les particules constituant la lumière). La différence d'énergie entre le photon incident et le photon émis est généralement convertie en chaleur.

Comme l’énergie d’un photon croît dans le spectre en allant du rouge vers le violet, cela signifie que la lumière émise est nécessairement décalée vers le côté
rouge du spectre par rapport à la lumière absorbée. Par exemple une lumière violette peut provoquer l’émission de lumière bleue, mais pas l’inverse (sauf dans une situation très particulière,
voir la remarque plus bas).
La situation est encore plus intéressante pour la lumière ultraviolette. Celle-ci, parfois appelée « lumière noire » car elle est invisible à nos yeux, est située
dans le spectre au-delà du violet. Elle est donc composée de photons plus énergétiques que tous ceux du domaine visible. Son absorption peut induire une émission de lumière visible, a priori
possible de n’importe quelle couleur, variant selon la nature de la substance fluorescente. Ce phénomène permet ainsi de convertir de la lumière invisible en lumière visible. Voilà pourquoi quand
on éclaire un objet fluorescent avec de la lumière ultraviolette il donne l’impression de créer de la lumière à partir de rien : sa source d’énergie ne nous est pas visible. Cet effet peut être
obtenu avec une lampe « UV » mais aussi avec la lumière du Soleil, qui contient un peu d’ultraviolets.
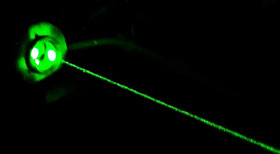
Remarque
Il existe des phénomènes plus rares et plus complexes, qui permettent à l’inverse de convertir des photons de faible énergie en photons de haute énergie. Par exemple en combinant l’énergie de deux photons infrarouges on peut obtenir un photon vert. C’est ce qui se passe dans les pointeurs laser verts, qui contiennent un émetteur laser infrarouge dont l’émission est transformée en lumière verte lors de la traversée d’un cristal appelé « YAG ».
Quelle différence entre couleur « classique » et couleur « fluo » ?

Pour aller plus loin, nous proposons de comparer différents liquides, colorés ou non, fluorescents ou non. Nous utilisons ici de l’eau, du Schweppes et différents colorants dilués dans de l’eau : un colorant alimentaire jaune, de la fluorescéine (un colorant utilisé comme traceur des cours d’eau) et de la rhodamine (un colorant utilisé en laboratoire).
Éclairés à la lumière du jour, les deux premiers se ressemblent : ils sont tous deux transparents et incolores (le Schweppes se reconnaît par ses bulles !). Les trois suivants sont colorés, mais en observant attentivement les deux derniers on se rend compte qu’il est difficile de leur attribuer une couleur. En effet celle-ci dépend de la façon dont on les regarde ! La couleur observée en regardant à travers le volume du liquide (en mettant par exemple une feuille de papier blanc derrière le verre) est différente de celle qui apparaît à sa surface. Cet effet se remarque d’autant plus que le colorant est concentré et éclairé par une lumière intense. Les deux photos suivantes, prises dans un faisceau de lumière venant du Soleil à gauche, le montrent plus clairement : la couleur transmise se voit à l’arrière du flacon et la couleur émise sur la surface avant du flacon.

Avant d’interpréter ces résultats, plaçons nos cinq liquides dans une pièce obscure et éclairons-les avec une lampe UV (celle utilisée ici émet aussi un peu de lumière violette).

On observe que l’eau pure et l’eau avec le colorant jaune sont très sombres. C’est bien ce qui est attendu puisque la lumière qui les éclaire est quasiment invisible, autrement dit l’expérience est faite quasiment « dans le noir ». En revanche le Schweppes, la fluorescéine et la rhodamine apparaissent lumineux. Ils ne se contentent donc pas de renvoyer la lumière qu’ils reçoivent, sans quoi ils seraient sombres comme les deux autres liquides. Ils émettent de la lumière visible comme s’il s’agissait de lampes. Le Schweppes émet ainsi une lumière diffuse bleutée qu’on ne voyait pas dans l’expérience précédente réalisée à la lumière du jour. La fluorescéine émet une lumière verte et la rhodamine une lumière jaune-verte, déjà remarquées dans l’expérience précédente. Comment expliquer cela ?
C’est la spectroscopie qui va nous aider à comprendre. À l’aide d’un spectromètre, nous avons mesuré deux types de courbe :
- un spectre de transmission, qui chiffre pour chaque composante spectrale la quantité de lumière traversant un des liquides, comparée à l’eau pure ; si la transmission est proche de 100 %, cela signifie que toute la lumière traverse le liquide comme s’il s’agissait d’eau pure ; si elle est plus faible, cela signifie que la lumière est atténuée : elle a été essentiellement absorbée par le colorant ;
-
un spectre d’émission, qui montre la lumière émise par le liquide ; cette émission se faisant toutes les directions, pour
mieux la différentier de la lumière transmise on la mesure dans une direction perpendiculaire à celle de la lumière incidente (ici celle d’une LED blanc froid, sauf pour le Schweppes où on a
utilisé une lampe UV).

Pour chaque liquide, on présente le spectre de transmission au-dessus du spectre d’émission, de façon à les comparer facilement, ainsi que les photos en éclairage lumière du jour et UV.

Commençons par le colorant jaune : son spectre de transmission montre qu’il absorbe la lumière incidente dans la gamme du bleu au violet. Les composantes spectrales
transmises, du vert au rouge, sont perçues jaune par synthèse additive par notre système de
vision. Ce colorant n’étant pas fluorescent, il n’émet pas de lumière (la lumière jaune qu’il transmet est trop faiblement diffusée dans le liquide ou réfléchie sur les parois du récipient pour
donner un signal mesurable avec notre appareil).
La fluorescéine absorbe la lumière dans la gamme des bleu-cyan, ce qui est cohérent avec sa couleur orange (complémentaire du bleu-cyan) quand on regarde à travers
le volume du liquide. Mais cette fois on mesure une émission intense dans le vert. Ce colorant renvoie une partie de l’énergie gagnée par absorption de photons bleu-cyan sous forme de photons
d’énergie un peu plus faible : c’est la lumière verte émise. Si le colorant est assez concentré, l’émission fluorescente se remarque surtout à la surface du liquide car c’est là que se produit
l’essentiel de l’absorption. Si on éclaire le liquide avec une lampe UV, les photons plus énergétiques encore pourront produire également cette émission de lumière verte.
Le même raisonnement peut s’appliquer à la rhodamine : ce colorant absorbe la lumière dans la gamme des verts, donc transmet une lumière de la couleur
complémentaire c’est-à-dire magenta (addition des lumières bleues et rouges). Elle émet de la lumière jaune-verte, composée de photons moins énergétiques que ceux de la lumière verte
absorbée.
Le spectre de transmission du Schweppes montre une faible absorption de la lumière dans la gamme du visible, essentiellement dans la région du violet où notre œil
est peu sensible. C’est ce qui explique son aspect quasi incolore à la lumière du jour. Notre appareil ne nous permet pas de faire de mesure dans la gamme UV mais la diminution progressive de la
transmission du bleu vers le violet laisse supposer que ce liquide absorbe la lumière proche UV. Sous une lampe UV on observe en effet une faible émission fluorescente bleue. La fluorescence de
ce soda vient de la quinine et se retrouve donc dans toutes les boissons appelées « tonic » qui en contiennent.
Pour résumer
La règle habituelle qui dit que « la couleur d’un objet est complémentaire de celle qu’il absorbe » s’applique pour la lumière transmise par ces liquides. Or quand
on observe un objet fluorescent, la couleur qu’on remarque le plus correspond non pas à la lumière transmise mais plutôt à celle émise. La règle est donc : « la couleur d’un objet fluorescent est
celle absorbée décalée vers le côté rouge du spectre ».

Et la phosphorescence ?
Dans le langage courant, les confusions entre les phénomènes de fluorescence et de phosphorescence sont fréquentes. Dans les deux cas il s’agit d’un phénomène dans lequel une absorption de lumière est suivie d’une émission de lumière. C’est ce qu’on appelle la photoluminescence, par opposition à d’autres phénomènes comme la chimiluminescence (voir plus loin) ou l’électroluminescence (mise en jeu dans les lampes à LED), dans lesquels l’émission de lumière fait suite respectivement à une réaction chimique ou à un processus électrique.

Quand un matériau gagne de l’énergie par absorption de lumière, il ne la rend jamais immédiatement. Toutefois la durée entre l’absorption et l’émission de lumière est le plus souvent tellement courte qu’on ne peut la ressentir à l’œil nu. C’est le cas pour les matériaux fluorescents, qui cessent d’être lumineux dès qu’on ne les éclaire plus. Les matériaux phosphorescents ont un délai d’émission plus long, typiquement plus d’une seconde, car le processus de transfert d’énergie est plus délicat à opérer. Si la source lumineuse est coupée brutalement, leur émission s’éteint progressivement en un temps qui peut donc être sensible à notre échelle. C’est ce que montre ce graphique, réalisé à partir de la vidéo précédente. En passant la vidéo image par image, on a relevé l’intensité de la lumière verte émise par un point de l’écran phosphorescent (ronds noirs), après éclairage par un laser violet. La variation de l’intensité émise au cours du temps suit assez précisément une courbe mathématique qu’on rencontre très souvent en physique : l’exponentielle (ligne bleue).

Étymologiquement, le terme « phosphorescent » signifie « qui porte la lumière ». Par abus de langage, certains spécialistes appellent « phosphore » les matériaux qu’ils utilisent pour leur propriété de phosphorescence. Pourtant le « vrai » phosphore (qui est un élément chimique bien particulier) n’est pas phosphorescent ! Historiquement il a reçu ce nom car il émettait de la lumière lors d’une réaction chimique, mais ce phénomène n’avait rien à voir avec la phosphorescence telle qu’elle est définie aujourd’hui. Le terme « fluorescence » quant à lui provient de la contraction de « fluor » et « opalescence ». Il fut adopté suite à des observations effectuées sur des cristaux naturels de fluorine, qui émettent de la lumière bleue-violette quand ils sont éclairés par des UV. Vous en avez peut-être vu lors d’une visite dans un muséum d’histoire naturelle, où l’on présente souvent des cristaux sous lumière UV pour mettre en évidence leur fluorescence. Mais là encore les apparences sont trompeuses car la fluorescence de la fluorine ne provient pas du fluor lui-même, pourtant présent en abondance dans ces cristaux, mais de terres rares présentes à l’état de traces.
Quelques applications
La fluorescence permet de rendre des objets plus lumineux, la phosphorescence leur permet en outre de continuer à émettre de la lumière (pendant un temps limité) quand ils n’en reçoivent plus. Les phénomènes décrits ici montrent que la lumière est une énergie qu’un objet peut recevoir, stoker, convertir, renvoyer. Cela mène à de nombreuses applications, certaines connues du grand public (surligneurs, signalisation, écrans de montres, …) et d’autres moins.

La fluorescence est par exemple utilisée en imagerie pour faire apparaître des choses qui sinon ne sont pas bien visibles. Pour cela, on injecte des colorants fluorescents dans l’objet qui nous intéresse (on parle de « marqueur fluorescent ») et on l’éclaire avec une source de lumière contenant des UV. Les photons UV de la lumière incidente étant plus énergétiques que l’ensemble des photons du spectre visible, cette lumière peut produire des émissions fluorescentes dans une grande variété de couleurs suivant les colorants utilisés.

Non toxique, la fluorescéine est un colorant couramment utilisé pour suivre le cheminement des cours d’eau. On en met même dans la rivière à Chicago lors de la fête de la Saint Patrick !
La fluorescence est aussi utilisée dans les nouvelles technologies de lampes d’éclairage : les tubes fluo émettent à l’origine surtout de la lumière UV, convertie par fluorescence en lumière visible répartie dans tout le spectre ; les LED actuelles émettent de la lumière bleue, convertie par fluorescence en jaune. Pour ces conversions, on utilise notamment des composés à base de terres rares. Ces technologies permettent d’obtenir une lumière blanche avec une bonne efficacité énergétique.
Et les vers luisants dans tout ça ?

La lumière émise par ces vers (ou lucioles) peut ressembler à celle émise par un surligneur fluo : les vers n’ont pas de pile et pourtant ils sont lumineux ! Mais contrairement à ce qu’on peut lire parfois, ce phénomène n’est ni de la fluorescence ni de la phosphorescence. Pour émettre sa lumière verte, le ver luisant n’utilise pas la lumière qu’il reçoit mais réalise une réaction chimique, qui dissipe de l’énergie sous forme de lumière, comme d’autres réactions peuvent dissiper de l’énergie sous forme de chaleur par exemple. On dit qu’il est chimiluminescent (émission de lumière après réaction chimique) ou plutôt ici bioluminescent car la réaction chimique a lieu dans un être vivant. C’est la même chose pour les bâtons lumineux que les enfants portent parfois en bracelet : en cassant le tube on fait entrer deux produits chimiques en contact. La réaction déclenchée par le mélange dissipe de l’énergie sous forme de lumière, pendant un certain temps …
